Obecná a anorganická chemie
Autorka: Tatiana Kovalčíková; 108 stran 16 x 23,4 cm,
páté, upravené vydání v roce 2024. Přehledný výklad základního učiva využitelný na všech typech středních škol
Ukázka z textu:
Síra S
Výskyt
V přírodě se vyskytuje volná i vázaná. Největší naleziště elementární síry jsou v USA, Mexiku a Polsku.
Vázaná se vyskytuje ve formě sulfidů:
- CuFeS2 - chalkopyrit;
- FeS2 - pyrit;
- PbS - galenit;
- ZnS - sfalerit;
Ze síranů jsou významné:
- BaSO4 - baryt;
- CaSO4.2 H2O - sádrovec.
Nachází se také v zemním plynu (jako H2S) a ropě.
Vlastnosti
Síra je žlutá, křehká krystalická látka. V závislosti na vnějších podmínkách se vyskytuje v několika modifikacích:
- síra kosočtverečná je stálá do teploty 96,5 °C;
- síra jednoklonná je stálá v intervalu teplot 96,5 °C – 119 °C.
Obě modifikace jsou tvořeny molekulami S8, v nichž jsou atomy uspořádány do kruhu. V roztavené síře při teplotě vyšší než 160 °C se molekuly S8 štěpí a vznikají dlouhé řetězce polymerní síry Sn. Náhlým ochlazením kapalné síry vzniká plastická síra.
Síra vře při 444,5 °C a při vyšších teplotách tvoří molekuly S8, S6 a S2. Ochlazením par vroucí síry se získá sirný květ.
Síra je nerozpustná ve vodě, ale dobře rozpustná v nepolárních rozpouštědlech. Po zahřátí hoří modrým plamenem za vzniku plynného SO2:
S + O2 --> SO2
Síra je poměrně reaktivní prvek, s většinou kovů se po zahřátí slučuje za vzniku sulfidů.
Síra je důležitý biogenní prvek, je součástí bílkovin.
Výroba
Stále větší význam pro získávání síry má její izolace ze zemního plynu. Metoda spočívá v tom, že H2S se nejdříve ze zemního plynu izoluje a sulfan se pak při omezeném přístupu vzduchu katalyticky oxiduje na síru.
Použití
- k výrobě kyseliny sírové a dalších sloučenin;
- jako vulkanizační přísada při výrobě kaučuku;
- při výrobě farmaceutických preparátů;
- k výrobě pesticidů.
Sloučeniny
Sulfan (sirovodík) H2S
Je to prudce jedovatý bezbarvý plyn, zápachem připomínající zkažená vejce.
Vzniká při rozkladu bílkovin. Bývá rozpuštěný v minerálních vodách. Vzniká také jako vedlejší produkt při zpracování ropy a uhlí.
Obvykle se připravuje reakcí sulfidů kovů s kyselinami:
FeS + 2 HCl --> FeCl2 + H2S
Sulfan má silně redukční účinky. Na vzduchu hoří podle reakce:
2 H2S + 3 O2 --> 2 SO2 + 2 H2O
Sulfan se rozpouští ve vodě na „sulfanovou vodu“. Je to slabá dvojsytná kyselina.
Tvoří soli:
- hydrogensulfidy HS–;
- sulfidy S2–.
Většina sulfidů kovů (s výjimkou sulfidů Li, Na, K, Ca, Sr, Ba) je ve vodě nerozpustná, vesměs jsou charakteristicky zbarvené. Připravují se srážením z roztoků solí příslušných kovů sulfanem.
Oxid siřičitý SO2
Bezbarvý plyn charakteristického štiplavého zápachu. Je jedovatý, dráždí dýchací cesty a ničí mikroorganismy.
Průmyslová výroba:
S + O2 --> SO2
Laboratorní příprava:
Na2SO3 + 2 HCl --> 2 NaCl + SO2 + H2O
Cu + 2 H2SO4 (konc.) --> CuSO4 + SO2 + 2 H2O
Jako nežádoucí složka se SO2 dostává do ovzduší spalováním uhlí a topných olejů. Podporuje korozi kovů, ničí jehličnaté lesy a jinou vegetaci, ohrožuje lidské zdraví.
Používá se k výrobě kyseliny sírové, k dezinfekci, k odbarvování látek, v chladírenství, v potravinářství jako konzervační činidlo.
Rozpuštěním oxidu siřičitého ve vodě vzniká slabá dvojsytná kyselina siřičitá H2SO3.
Siřičitany mají silně redukční účinky, v roztoku se snadno oxidují na sírany.
Používají se k bělení papíru, vlny a jako dezinfekční prostředek.
Oxid sírový SO3
Existuje ve třech skupenstvích. V plynném skupenství tvoří molekuly SO3, v kapalném a pevném tvoří trimer (SO3)3, příp. polymer (SO3)n – podle podmínek.
Vzniká reakcí:
| 2 SO2 + O2 | 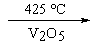 |
2 SO3 |
Kyselina sírová H2SO4
Je bezbarvá olejovitá kapalina, téměř dvakrát těžší než voda. S vodou se mísí v libovolném poměru a při tom se uvolňuje velké množství tepla. Je to silně hygroskopická látka, která má mohutné dehydratační účinky. Organické látky se jejím působením zbavují vody (dehydratují) a uhelnatí.
Koncentrovaná kyselina působí za tepla oxidačně.
Je to silná dvojsytná kyselina, tvoří soli:
- sírany SO42–;
- hydrogensírany HSO4–.
Většina síranů a všechny hydrogensírany jsou ve vodě dobře rozpustné.
Výroba kyseliny sírové sestává ze tří fází:
1. výroba SO2
2. oxidace SO2 na SO3
3. pohlcování SO3 ve zředěné kyselině sírové (tím se její koncentrace zvyšuje).
Dalším pohlcováním SO3 v konc. H2SO4 vzniká oleum (dýmavá kyselina sírová).
Oleum s obsahem: 20 % a 60 % SO3 – kapalina, 40 % SO3 – pevná látka.
Kyselina sírová je základní průmyslová surovina. Používá se na výrobu:
- průmyslových hnojiv;
- barviv a pigmentů;
- syntetických vláken a polymerů;
- léčiv a solí;
- výbušnin;
- jako elektrolyt do akumulátorů;
- ...
Hlavní kapitoly
ÚVOD DO STUDIA CHEMIE
STRUKTURA ATOMŮ
ATOMOVÉ JÁDRO
ELEKTRONOVÝ OBAL ATOMŮ
PERIODICKÁ SOUSTAVA PRVKŮ
NÁZVOSLOVÍ ANORGANICKÉ CHEMIE
CHEMICKÁ VAZBA
REAKČNÍ KINETIKA
TERMOCHEMIE
CHEMICKÉ ROVNOVÁHY
CHEMICKÉ REAKCE
CHEMICKÉ VÝPOČTY
NEPŘECHODNÉ PRVKY
KOVY
PŘECHODNÉ PRVKY
